对元反应来说,阿伦尼乌斯公式中的活化能(Ea)是活化分子的平均能量跟所有分子的平均能量的差。碰撞理论认为,分子碰撞的剧烈程度不取决于A、B两个分子的总移动能,而取决于它们在质心连线方向上的相对移动能。只有这个能量超过某一数值(叫临界能εc)时反应才能发生,碰撞理论就把εc×NA=Ec叫做反应活化能(NA是阿佛加德罗常数)。关于活化能定义目前还没有完全统一的提法,随着反应速率理论的发展,人们对这概念的理解在不断深化。反应活化能的大小由反应物分子性质所决定,也就跟分子的内部结构密切相关。不同反应有不同的活化能(Ea),Ea越低,反应进行得越快。在通常反应温度下,大多数反应的活化能在40~400kJ/mol范围内。一般的中和反应Ea<40kJ/mol,所以中和反应速率很大,用通常的方法难以测定。活化能的实验测定常用阿伦尼乌斯公式的不定积分形式求得
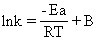
只要测得几个不同温度下的反应速率常数k,以lnk对1/T作图,得到一条直线,由它的斜率-Ea/R就可求得活化能Ea=-(斜率)×R(R是气体常数)。

