一、简介:
1 细胞质膜资料
1895年,Overton从研究细胞透性得出"细胞膜由连续的脂类物质组成"。
1925年 Gorter&Grendel:用脂单分子膜技术测定细胞膜中脂分子的总面积,提出:"细胞膜是由双层脂分子组成"。
1935年 Danielli&Davson:从测定膜的表面张力得出细胞膜的"三明治结构模型",即蛋白质-脂-蛋白质。
1959年 Robertson:用电镜观察生物膜提出"单位膜模型",将膜的分子结构与超微机构统一起来
厚度: 2(暗) 3.5(亮) 2(暗)=7.5
细胞质膜的主要功能概括如下:
(1) 为细胞的生命活动提供相对稳定的内环境;
(2) 选择性的物质运输,包括代谢底物的输入与代谢产物的排除,其中伴随着能量的传递;
(3) 提供细胞识别位点,并完成细胞内外信息跨膜传递;
(4) 为多种酶提供结合位点,使酶促反应高效而有序地进行;
(5) 介导细胞与细胞、细胞与基质之间的连接;
质膜参与形成具有不同功能的细胞表面特化结构。
2 膜蛋白
虽动物细胞主要有9种膜脂,而膜蛋白的种类繁多,多数膜蛋白分子数目较少,但却赋予细胞膜非常重要的生物学功能。
根据膜蛋白分离的难易及其与脂分子的结合方式,膜蛋白可分为两大类型:外在膜蛋白、内在膜蛋白。
(1) 外在膜蛋白为水溶性蛋白,靠离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合,因此只要改变溶液的离子强度甚至提高温度就可以从膜上分离下来,膜结构并不被破坏。
(2) 内在膜蛋白与膜结合非常紧密,一般讲只有用去垢剂(detergent)使膜解后才可分离出来。
获得大量有生物学活性的质膜蛋白对我们显得非常的重要。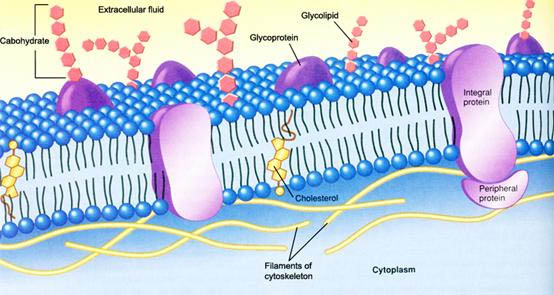
附注:使用分级抽提方法获得的“膜蛋白”中只有很少一部分是具备多跨膜区的整和膜蛋白,膜蛋白,到目前为止,仍然是蛋白组学的一个瓶颈,不管采用2-D技术也好,ICAT乃至proein microarray都还不能有效解决这一问题。
二、蛋白抽提
谈及蛋白分离,我们想到:超速离心,盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法……有时这些方法常常组合到一起对特定的物质进行分离纯化。由于蛋白质种类繁多,不同的蛋白质由于结构和组成的差异,其溶解度也各不相同.根据蛋白质的溶解特性,同时可选择不同的溶剂提取,分为水溶液提取和有机溶剂提取.
但是针对膜蛋白的提取与细胞质蛋白,核蛋白提取不同之处在于它是嵌在膜中的,水溶性不好,基本方法就是用不同的离心速度去掉胞质蛋白等,最后用去污剂把蛋白从膜中释放出来。膜蛋白分离纯化的重要步骤是选择适当的增溶用表面活性剂,一般常用的有胆酸盐,CHAPS(一种离子去污剂),Emulgen和Lubrol等表面活性剂。
1、分离膜蛋白的方法(原则性):
1) 先分离膜,然后提取;如选用冷热交替法、反复冻融法、超声破碎法、玻璃匀浆法、自溶法和酶处理法使得细胞破碎,然后通过剃度离心得到含有膜蛋白的粗组分。(例如:michael11液氮研磨组织,加入匀浆缓冲液及蛋白酶抑制剂。差速离心。蔗糖密度梯度离心。收集37%与41%间的成分,即为质膜部分。裂解即可收集膜蛋白 )
2 )用特殊的去污剂选择性的分离。 从膜上提取蛋白有许多困难.在多数情况下,都是采用去垢剂将疏水蛋白从其膜结构中溶解下来,然后将蛋白质稳定.去垢剂的选择通常是依据他对所需要蛋白质的提取效率来确定,但在某些情况下,还要考虑到以后的纯化步骤.虽然许多膜蛋白必须在去垢剂存在的情况下进行纯化,但最终仍可能需要除去去垢剂.这常常会引起蛋白质失活,但如果蛋白质是用于测序的,他将不是一个问题.如果不是用于测序的,可考虑使用能够黏附去垢剂的疏水珠.许多文献和生化试剂供应商的产品目录中,都介绍有许多种不同的可用来溶解膜蛋白的去垢剂.然而,他们并不是普遍适用的.在设计膜蛋白溶解方案时,必须考虑某一去垢剂的特殊性质.如 triton X-100在280nm处有吸收,如果某蛋白质的测试与280nm处的吸收有关,就应避免使用这类去垢剂.
将膜制剂与胞质蛋白及细胞核分离后,再进一步从细胞膜制剂中将所需的膜蛋白增溶下来.这种做法的好处是可以用强烈的去垢剂提取细胞骨架的相关蛋白,而无需考虑胞质蛋白、细胞核成分或染色质成分的混入.使用这种方法所获得的膜蛋白,无论在种类上还是数量上,都比酸溶解法所得到的蛋白(<5000Da)要多.一般提取的膜蛋白量往往只占膜蛋白总量的不足0.1%,所以充分的膜蛋白的提取,无疑对于研究膜蛋白的结构和功能都是非常重要的. 第二种方法简单,可靠,但有时含有其他蛋白。一般的都是利用4度时所有的蛋白质原则上都溶于TritonX114水溶液,在温度超过20度时,此溶液分为水相和去污相;此时亲水性蛋白溶于水相,疏水的膜蛋白溶于去污剂相中。利用此性质可提取膜蛋白。
3 )膜蛋白色谱(Chromatography of Membrane Protein,CMP)CMP 分离强疏水性蛋白、多肽混合物的层析系统,一般有去垢剂(如SDS)溶解膜蛋白后形成SDS-融膜蛋白,并由羟基磷灰石为固定相的柱子分离纯化。羟基磷灰石柱具有阴离子磷酸基团(P-端),又具有阳离子钙(C-端),与固定相结合主要决定于膜蛋白的大小、SDS结合量有关。利用原子散射法研究cAMP的分离机制发现,样品与SDS结合后在离子交换柱上存在SDS分子、带电荷氨基酸与固定相中带电离子间的交换,从而达到分级分离的目的。
层析柱提取 http://www.alomone.com/ (参步骤)
4) 顺序抽提法:根据细胞蛋白溶解性的差异,用具有不同溶解能力的蛋白溶解液进行抽提的方法。用Tris碱溶液裂解细胞提取高溶解性蛋白;把未溶解的pellet用标准液溶解提取高疏水性蛋白;最后用含复合表面活性剂的蛋白溶解液,最后可以再次抽提前两次抽提后不能溶解的膜蛋白。
5)centrifugal protein extraction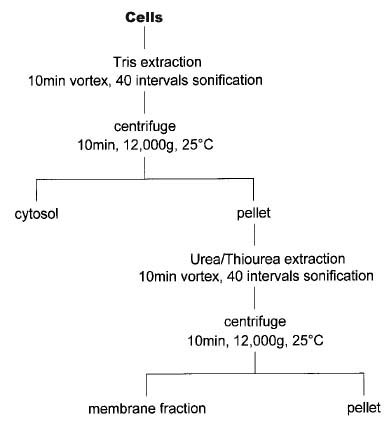
原理:高渗的蛋白裂解液让细胞溶涨破裂后,超高速离心
评价:尽管分级(胞浆和胞膜)之间有清洗的步骤,但是可溶蛋白组分和膜蛋白组分之间仍然有不少重复的点.该方法相较MOLLOY MP教授在1998年electrophoresis上发表的分级抽提法减去了第一步(用tris抽提水溶性蛋白)和最后一步(极难溶蛋白),在操作上也作了简化,总而言之是一种不错的方法。(codegreen)
6)detergent- based:提取时先裂解液裂胞膜(选用不同的去污试剂是关键),梯度离心分离细胞器(ER),然后分级抽提方法。例如,去掉细胞器之后的DEBRIS就是核膜,再裂解得到核膜蛋白。而膜蛋白是裂胞膜时不溶的部分。
总的感受:细胞的量要很充足。之后的定性鉴定常用的方法有双向免疫扩散、免疫电泳及聚丙稀酰胺凝胶电泳等。纯化蛋白质浓度的定量测定可用双缩脲法、酚试剂法或紫外光吸收法定量鉴定膜蛋白,方便迅速。
到目前为止,提取膜蛋白仍然是蛋白学的一个瓶颈。
2、分离膜蛋白的方法(操作)
1)分离细胞膜蛋白的方法:
1 冰上刮下细胞后将细胞溶于有蛋白酶抑制剂的缓冲液A中,于室温与液氮罐中反复冻融2次。
2 5000转4度离心,驱除核及未裂解的细胞。
3 取上清12000转4度离心10分钟取沉淀溶于有蛋白酶抑制剂的缓冲液B中。
4 12000转4度离心10分钟取沉淀溶于有蛋白酶抑制剂的缓冲液C中提取后测蛋白浓度,SDS-PAGE电泳,分装后-20度保存备用。
buffer A : 1mMkcl,5mMNacl,3mM Mgcl2,50mM Hepes,1mM DTT,0.5ug/ml Leupeptin,20uM pmsf(PH=7.4)
buffer B : 1mMkcl,5mMNacl,3mM Mgcl2,50mM Hepes,1mM DTT,0.5ug/ml Leupeptin,20uM pmsf(PH=7.4) 1mM EGTA
buffer C : 0.5ug/ml Leupeptin,20uM pmsf,50mMTris-cl(PH=7.0),
2)分离细胞膜蛋白的方法:
1、细胞放在冰上,去除上清,用pH7。4的冷磷酸盐缓冲液洗涤单层细胞两次
2、加入1ml2%TritonX溶液冰浴15min
3、刮下单层细胞,4度下10 000g 5min离心
4、溶液37度水浴 10min以分离水相和去污剂相,然后37度下2 000g离心5min
5、收集水相留作分析
6、用500ul冰冷的buffer C溶解去污剂相沉淀,冰浴2min后加温,在按步骤6再次离心
7、按步骤8再次抽提去污剂相,用buffer C将洗涤后的去污剂相稀释到初始体积
8、用等量的buffer A分别稀释水相与去污相,并进行免疫沉淀实验
试剂:
1、2%tritonX114:2%TritonX114、50mmol/L Tris HCl(pH7。5)、蛋白酶抑制剂
2、缓冲液A(含0。5mol/LNaCl的RIPA buffer)
3、buffer C
10mmol/L Tris HCl(pH7.5)
150mmol/L NaCl
5mmol/L EDTA(PH7.5)
3)分离细胞膜蛋白的方法:
7M urea
2M thiourea
4%chaps
2.5%sb3-10
1000000个细胞,可用此 buffer 1ml。 冰浴匀浆。冰上置30分钟。
4度高速低温离心30min。
取上清-20保存。
4)分离组织膜蛋白的方法:
1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。弃去上清,沉淀用适量的 Buffer B重悬,冰上孵育2hr后分装至EP管, Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。 冰上预冷。
5)分离组织膜蛋白的方法:
RIPA
1XPBS
1%NP40
0.5去氧胆酸钠
0.1%SDS
以下用时加入
10mg/ml PMSF异丙醇(终浓度10ul/ml)
Aprotinin(30ul/ml)
1000mM Sodium Orthovandate(10ul/ml)
冰冻组织100mg/细胞1000000个,可用RIPA buffer 1ml。 冰浴匀浆。冰上置30分钟。
4度高速离心30min,20000转低温离心最佳。
取上清-20保存。
6)分离细菌膜蛋白的方法:
① 于20ml 营养肉汤中过夜培养细菌,37℃,200rpm。
② 10000g、20min、4℃离心,去上清。
③ 20ml预冷的Tris-Mg缓冲液重悬,同样条件离心,再重悬于预冷的Tris-Mg缓冲液。
④ 超声波破碎细菌。
⑤ 3000g,10min、室温下离心去除未破碎细菌。小心吸取上清(含有胞质成分和细菌外被成分)。
⑥ 超速离心I:100,000g,60min,4℃,去除上清(胞质成分),收集细菌外被成分。
⑦ 用10ml含2%的SLS的Tris-Mg 缓冲液重悬沉淀物,室温温育20-30min。
⑧ 超速离心II:70,000g,60min,室温沉淀收集外膜蛋白,去除上清(含细胞质膜)。重复⑦、⑧两步。
⑨ 充分吸除上清,并根据沉淀体积大小用0.1-0.2 ml的ddH2O重悬沉淀物。根据公式:蛋白浓度(mg/ml)=1.450 D280-0.740 D260测定外膜蛋白浓度,调节蛋白浓度至40ug/ul,该蛋白质样品-70℃贮存。
试剂
① Tris-Mg 缓冲液
10mM Tris-Cl
5mM MgCl2
pH 7.3,4℃保存
② 2%(w/v)十二烷基肌氨酸钠 (SLS)
7)来源于Methods Enzymology (1974)
1.取一定量酶处理的细胞,用匀浆器破碎,操作要温和,使细胞膜保持完整。由于水与膜的疏水部分之间有反应,因此要精确掌握分离介质中的离心强度和渗透压,以每克细胞湿重加40ml介质。
2.用Potter-Elvehiem匀浆器,杆与壁间间隙0.5~0.6μm,14.4kr/min上下匀浆4~6次,每次5S。
3.过滤匀浆液,150g离心10min,保留上清,沉淀部分加入50μl介质,用匀浆器1kr/min匀浆3次,150g离心10min,沉淀部分再加入上次匀浆的上清液。
4.合并3次上清液,2kg离心10min,弃上清,沉淀部分溶于100μl介质,离心10min,弃上清,留沉淀。
5.将沉淀部分加入70%蔗糖15份,然后分别置于三个离心管中,上面依次叠加54%、49%、45%,41%,37%蔗糖溶液各2、2、5、5、3份。
6.700kg离心90min,分离介质在1.16~1.18之间形成介面。
7.收集d为1.16~1.18g/ml之间的细胞膜,加30倍的介质以2.5kg离心10min,洗涤2次。
8.保存于2.7mmol/L Tris-HCl pH7.5缓冲液中,用于细胞膜的研究分析
8)常用的制备粗制质膜组分的方法:(所有操作都在4摄氏度下进行)
1.在冰冷的匀浆缓冲液中切碎组织块,倒出血水。用匀浆缓冲液漂洗组织碎块,并将它们置于冰上,重复上述操作,直至组织碎成1mm3大小的碎片,且无可见的血。
2.加入5倍(体积比)与组织块体积的缓冲液,再置于冰浴的Dounce氏玻璃匀浆器中,抽研10-20次,匀浆组织。
3.匀浆4摄氏度600g离心10min,上清含细胞膜、线粒体和细胞溶胶。沉淀中有未破碎的细胞及细胞核。弃沉淀。
4.上清4摄氏度8000g离心10min,沉淀线粒体。弃沉淀。
5.上清4摄氏度10000g离心20min,弃上清。
6.用匀浆缓冲液重悬沉淀,继续匀浆,再次4摄氏度,10000g离心20min,弃上清。
7.用小体积的适宜缓冲液重新彻底匀浆沉淀。
8.粗制的样品可于干冰/乙醇中速冻,保存于-80摄氏度。
9)用特殊的去污剂选择性的分离。简单,可靠,但有时含有其他蛋白。
原理:4度时所有的蛋白质原则上都溶于TritonX114水溶液,但在37度时,此溶液分为水相和去污相;此时亲水性蛋白溶于水相,疏水的膜蛋白溶于去污剂相中。
方案
1、放射性标记受试细胞
2、将标记的细胞放在冰上
3、去除上清,用pH7。4的冷磷酸盐缓冲液洗涤单层细胞两次
4、加入1ml2%TritonX溶液冰浴15min
5、刮下单层细胞,4度下10 000g 5min离心
6、溶液37度水浴 10min以分离水相和去污剂相,然后37度下2 000g离心5min
7、收集水相留作分析
8、用500ul冰冷的buffer C溶解去污剂相沉淀,冰浴2min后加温,在按步骤6再次离心
9、按步骤8再次抽提去污剂相,用buffer C将洗涤后的去污剂相稀释到初始体积
10、用等量的buffer A分别稀释水相与去污相,并进行免疫沉淀实验
试剂:
1)2%tritonX114:2%TritonX114、50mmol/L Tris HCl(pH7。5)、蛋白酶抑制剂
2)缓冲液A(含0。5mol/LNaCl的RIPA buffer)
3)buffer C
10mmol/L Tris HCl(pH7.5)
150mmol/L NaCl
5mmol/L EDTA(PH7.5)
10)植物中:高度纯化的质膜是质膜蛋白研究的基础,制备纯化方法也很多,植物材料中以1蔗糖密度梯度离心、2水溶性双水相法、3自由流电泳等方法为主。前两种常用。1的产率较高但纯度不高,2是20世纪80年代发展起来的一种分离高纯度质膜的方法,经多次双水相分配即可得到高纯度质膜,近些年此方法广泛用于植物质膜的纯化。
